Амфотерные оксиды – вещества, которые могут проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции. Эти вещества могут взаимодействовать как с кислотами, так и со щелочами.
Принцип действия амфотерных оксидов лежит в их способности принимать протоны от кислот или отдавать их щелочам. Если амфотерный оксид реагирует с кислотой, то он действует как щелочной оксид, а если реагирует со щелочью, то как кислотный оксид.
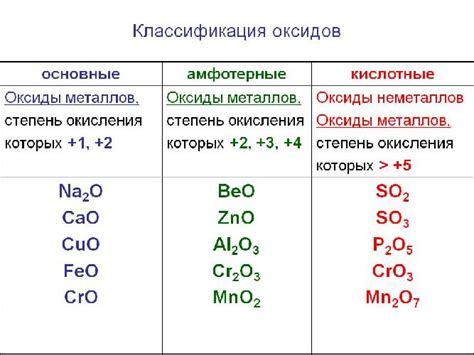
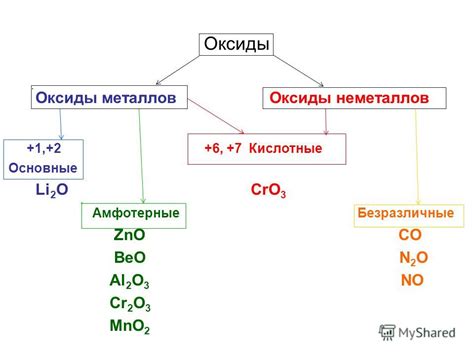
Примерами амфотерных оксидов являются оксиды алюминия (Al2O3), цинка (ZnO), свинца (PbO) и другие. Эти соединения нередко используются в различных отраслях промышленности и химии благодаря своей способности взаимодействовать как с кислотами, так и со щелочами.
Что такое амфотерные оксиды
Примером амфотерного оксида является оксид алюминия (Al2O3), который может реагировать как с щелочами, так и с кислотами, образуя соответствующие соли.
| Оксид | Формула | Проявление |
|---|---|---|
| Оксид алюминия | Al2O3 | Амфотерное |
Основные принципы реакции

1. Диссоциация: Амфотерные оксиды способны диссоциировать в растворе на ионы, которые могут реагировать как с кислотными, так и с основными компонентами.
2. Возможность протонного обмена: Амфотерные оксиды могут принимать и отдавать протоны в зависимости от pH среды, в которой они находятся.
3. Образование солей: При взаимодействии амфотерных оксидов с кислотами или основаниями образуются соли, которые могут быть кислотными или основными в зависимости от реакционной среды.
Химическое взаимодействие

У амфотерных оксидов есть уникальное свойство проявлять активность как кислоты, так и основания в зависимости от контакта с другими веществами. Это происходит из-за их способности образовывать как ион H+, так и ионы OH- в реакциях с кислотами и основаниями соответственно.
Амфотерные оксиды взаимодействуют с кислотами, образуя соль и воду, либо с основаниями, образуя соль и воду. Примерами амфотерных оксидов являются алюминий (Al2O3) и цинк (ZnO), которые способны проявлять характеристики как кислоты, так и основания.
Примеры амфотерных оксидов
1. Оксид алюминия (Al2O3)
Этот оксид обладает амфотерными свойствами и реагирует как с кислотами, так и с щелочами. Например, Al2O3 реагирует с кислотой с образованием алюминиевого соли и воды, а с щелочью - образуется алюминиевая соль и вода.
2. Оксид свинца (PbO)
Оксид свинца также является амфотерным оксидом. Он может реагировать как с кислотами, так и с щелочами, образуя соответствующие соли и воду.
3. Оксид цинка (ZnO)
По своим химическим свойствам оксид цинка также относится к амфотерным оксидам. Он может проявлять как кислотные, так и щелочные свойства в реакциях с различными соединениями.
Роль амфотерных оксидов в химии

Амфотерные оксиды играют важную роль в химии благодаря своей способности проявлять как кислотные, так и основные свойства. Благодаря этим свойствам амфотерные оксиды могут реагировать с различными типами веществ, что делает их уникальными и интересными для изучения.
Амфотерные оксиды могут взаимодействовать как с кислотами, образуя соли, так и с основаниями, образуя гидроксиды. Это делает их универсальными соединениями, способными проявлять разнообразные химические свойства в зависимости от условий реакции.
Примерами амфотерных оксидов являются оксид цинка (ZnO) и оксид алюминия (Al2O3), которые могут образовывать не только соли с кислотами, но и гидроксиды с основаниями.
Вопрос-ответ

Что такое амфотерные оксиды?
Амфотерные оксиды - это соединения, которые могут проявлять свойства как кислоты, так и щелочи в зависимости от условий. Они способны реагировать как с кислотами, так и с щелочами, образуя соли и воду.
Как происходит реакция амфотерных оксидов с кислотами?
Амфотерные оксиды при реакции с кислотами образуют соли и воду. В этом случае оксид выступает в роли основания, принимая протон от кислоты и образуя ион соли.
Какие примеры амфотерных оксидов существуют?
Примерами амфотерных оксидов являются оксиды алюминия (Al2O3), цинка (ZnO) и свинца (PbO). Эти соединения могут проявлять как кислотные, так и щелочные свойства в зависимости от условий.
В каких сферах применяются амфотерные оксиды?
Амфотерные оксиды широко применяются в качестве катализаторов, пигментов, абразивов и в других отраслях промышленности. Например, оксид цинка используется в производстве косметики, пигментов и солнцезащитных средств.
Какие свойства делают амфотерные оксиды уникальными?
Уникальность амфотерных оксидов заключается в их способности проявлять как кислотные, так и щелочные свойства в зависимости от условий окружающей среды. Это позволяет им взаимодействовать с различными типами веществ, делая их универсальными соединениями.