Электронная конфигурация атома является ключевым понятием в химии, позволяющим понять его строение и химические свойства. Она определяет распределение электронов атома по его энергетическим уровням и подуровням.
Принцип заполнения оболочек атома основан на правиле, что электроны заполняют орбитали сначала более низких энергетических уровней, прежде переходя на уровни более высокие. В данной статье мы рассмотрим примеры электронной конфигурации различных элементов и принципы её определения.
Что такое электронная конфигурация?
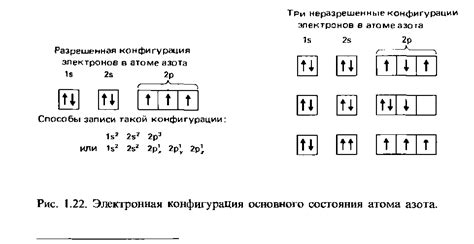
Электронная конфигурация состоит из набора квантовых чисел, которые описывают энергетическое состояние электронов в атоме. Квантовые числа включают главное квантовое число, орбитальное квантовое число, магнитное квантовое число и спиновое квантовое число.
Принципы электронного строения атомов
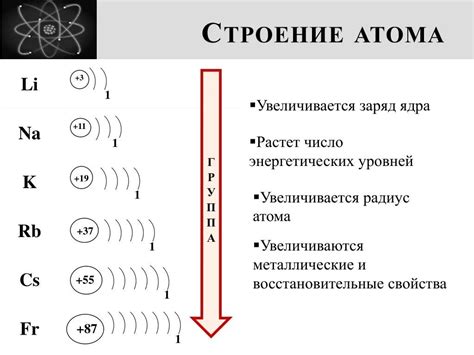
Электронное строение атомов определяется основными принципами, включающими правила, которые описывают распределение электронов по энергетическим уровням и подуровням в атоме. Основные принципы электронного строения атомов включают:
| 1. | Принцип Паули: | Каждый электрон в атоме характеризуется уникальным квантовым числом спина, и в одном атоме два электрона на одном орбитальном подуровне должны иметь противоположные знаки спина. |
| 2. | Принцип Клейна: | Атомные электроны занимают возможные энергетические уровни с минимальной энергией, заполняя их по порядку возрастания энергии. |
| 3. | Правило Хунда: | Для заполнения орбиталей подуровней, электроны распределяются так, чтобы их численность на каждой орбитали была максимальной и их спины совпадали. |
Эти принципы помогают объяснить распределение электронов в атоме и определить электронную конфигурацию атома, что является основой для понимания химических свойств элементов.
Структура электронной оболочки
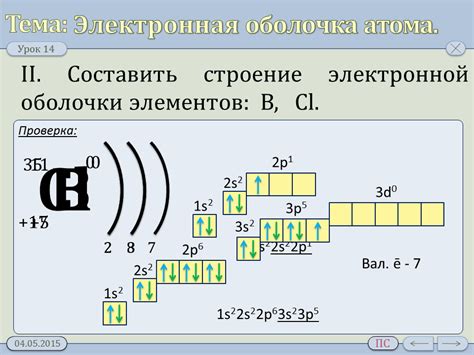
Электронная оболочка атома состоит из электронных уровней, на которых распределены электроны. Обычно оболочка состоит из нескольких уровней, каждый из которых может содержать определенное количество электронов. Основные уровни оболочки обозначаются буквами: K, L, M и т.д.
На каждом уровне могут находиться подуровни, обозначаемые буквами s, p, d, f и т.д. Электроны распределены по подуровням в соответствии с принципами заполнения подуровней: сначала заполняются подуровни с меньшим энергетическим уровнем, затем с более высоким.
Примеры электронной конфигурации элементов:
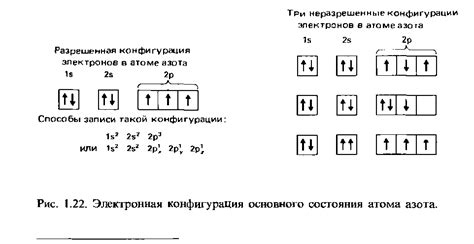
1. Водород (H): 1s1
2. Гелий (He): 1s2
3. Кислород (O): 1s2 2s2 2p4
4. Углерод (C): 1s2 2s2 2p2
5. Натрий (Na): 1s2 2s2 2p6 3s1
6. Железо (Fe): 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Как определить электронную конфигурацию?
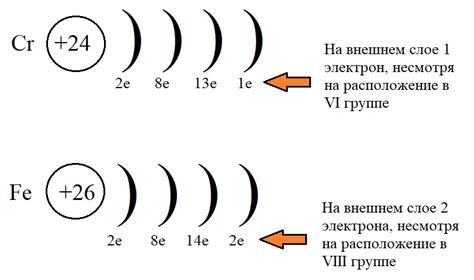
Электронная конфигурация атома определяется распределением электронов по энергетическим уровням и подуровням. Для определения электронной конфигурации следует следовать определенным шагам:
- Определить количество электронов в атоме по номеру в таблице химических элементов.
- Заполнить электронные оболочки начиная с наименьшего энергетического уровня.
- Учитывать правила заполнения электронных подуровней по принципу Афбау.
- Заполнить подуровни в соответствии с правилами Хунда и Паули.
По этим шагам можно определить электронную конфигурацию любого атома и использовать ее для дальнейших расчетов в химии.
Таблица Менделеева и электронная структура
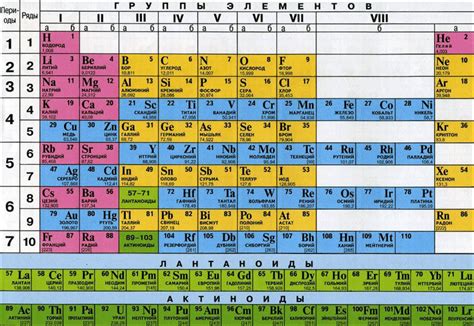
Распределение электронов в атомах элементов в таблице Менделеева соответствует основным принципам электронной структуры. Например, первый ряд элементов таблицы Менделеева (водород, гелий и т.д.) имеет по одному электрону во внешней оболочке, что делает их стабильными.
Электронная конфигурация элементов в таблице Менделеева помогает предсказывать и объяснять их химические свойства. Электроны в атоме располагаются в оболочках, и количество электронов во внешней оболочке определяет химическую активность элемента. Этот принцип позволяет установить закономерности в химии элементов и проводить их классификацию.
Способы представления электронных оболочек

Электронную конфигурацию атомов можно представить различными способами:
- По Гауссовским оболочкам:
- 1s, 2s, 2p, 3s, 3p и т.д.
- Например, 2, 8, 18, 32 и т.д., соответствующие очередным заполненным оболочкам.
- В энергетическом спектре атомов возможны различные уровни энергии и их заполнение электронами.
Вопрос-ответ

Что такое электронная конфигурация в химии?
Электронная конфигурация в химии - это распределение электронов по энергетическим уровням атома или иона. Она описывает, сколько электронов содержится на каждом энергетическом уровне и в каком порядке они занимают атомные орбитали.
Какое значение имеет электронная конфигурация для химии?
Электронная конфигурация играет важную роль в химии, поскольку она определяет химические свойства вещества. Позиция электронов на энергетических уровнях влияет на химическую активность атомов, ионов или молекул, и позволяет предсказывать их химическое поведение.
Каким образом можно определить электронную конфигурацию атома?
Электронную конфигурацию атома можно определить, используя таблицу Менделеева, а также правила заполнения атомных орбиталей. Для этого необходимо знать количество электронов в атоме и следовать правилам наполнения энергетических уровней и подуровней. Например, водородный атом имеет электронную конфигурацию 1s^1.