Изменение объема газа при охлаждении - это физический процесс, который подчиняется определенным законам и принципам. Понимание этого явления играет важную роль в различных областях науки и техники, особенно в химии и физике.
При охлаждении газа его молекулы замедляют свои движения, что приводит к уменьшению объема газа. Этот процесс описывается законом Бойля-Мариотта, согласно которому при постоянной температуре произведение давления и объема газа остается постоянным.
Если пренебречь изменениями идеальности газа, процесс охлаждения можно описать с использованием уравнения состояния газа. Таким образом, понимание изменения объема газа при охлаждении существенно при анализе различных физических и химических процессов.
Изменение объема газа

Изменение объема газа может происходить в зависимости от различных внешних условий, таких как температура, давление и объем контейнера, в котором находится газ.
При охлаждении газа его молекулы теряют кинетическую энергию и движутся медленнее, что приводит к уменьшению объема газа. Этот процесс называется уменьшением объема при понижении температуры.
При изменении объема газа важными законами являются закон Бойля-Мариотта, закон Шарля и уравнение состояния идеального газа. Они описывают зависимость между объемом, давлением и температурой газа.
Принципы изменения объема газа

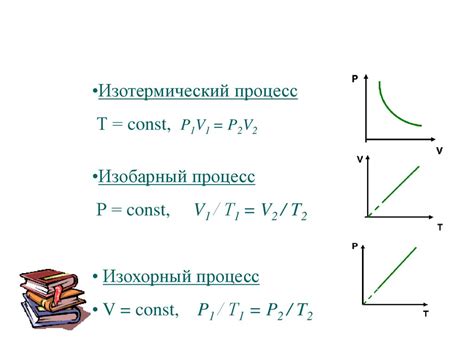
Закон Бойля утверждает, что при постоянной температуре давление газа обратно пропорционально его объему: PV = const. Это означает, что при уменьшении объема газа давление в нем увеличивается, и наоборот.
Закон Шарля говорит о прямой пропорциональности между объемом газа и его температурой при постоянном давлении: V/T = const. Поэтому при охлаждении газа его объем уменьшается, а при нагревании увеличивается.
Понимание этих принципов помогает объяснить изменение объема газа при охлаждении и применить их в различных физико-химических процессах.
Молекулярное движение в газах

Газ состоит из молекул, которые находятся в постоянном движении, сталкиваясь и отскакивая друг от друга. Молекулярное движение в газах описывается кинетической теорией газов, которая объясняет поведение газовых частиц и их взаимодействие.
Молекулы в газах двигаются по прямым линиям, пока не столкнутся с другими молекулами или стенками сосуда. При столкновениях молекулы меняют направление движения и скорость. Столкновения молекул обусловливают давление газа.
Средняя кинетическая энергия молекул газа пропорциональна их температуре. При нагревании газа, молекулы увеличивают скорость движения и чаще сталкиваются друг с другом или со стенками сосуда.
Термодинамические законы газов
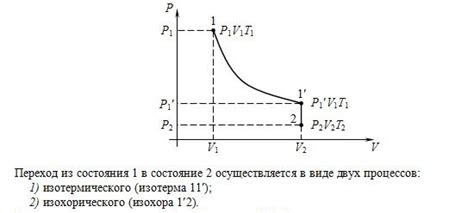
Также стоит упомянуть закон Гей-Люссака, который устанавливает прямую пропорциональность между давлением и температурой газа при постоянном объеме. Наблюдение и применение этих законов помогает понять, как изменяется объем газа при охлаждении и какие факторы на это влияют. Важно учитывать все законы при работе с газами, чтобы точно оценить их поведение и свойства.
Закон Шарля о температуре и объеме газа

Закон Шарля формулируется следующим образом: при постоянном давлении объем газа прямо пропорционален его абсолютной температуре. Это означает, что если температура газа увеличивается, то его объем также увеличивается, и наоборот. Закон Шарля справедлив при условии постоянного давления и подходит для идеальных газов.
Уравнение закона Шарля можно записать следующим образом: V1/T1 = V2/T2, где V1 и V2 - объем газа при начальной и конечной температуре соответственно, T1 и T2 - начальная и конечная температура газа.
Закон Шарля позволяет предсказывать изменения объема газа при изменении его температуры при постоянном давлении. Этот закон также полезен при решении задач на тему термодинамики и изменения объема газа в различных условиях.
Закон Бойля о давлении и объеме газа
Закон Бойля утверждает, что при постоянной температуре объем газа обратно пропорционален его давлению. То есть, при увеличении давления объем газа уменьшается, а при уменьшении давления объем увеличивается.
Математически закон Бойля выражается как P1V1 = P2V2, где P1 и V1 - начальное давление и объем, а P2 и V2 - конечное давление и объем.
Этот закон позволяет предсказать изменение объема газа при изменении давления или наоборот. Он играет ключевую роль в понимании поведения газов при различных условиях и широко используется в химических и физических расчетах.
Закон Гей-Люссака о температуре и давлении газа

Закон Гей-Люссака утверждает, что при постоянном объеме газа его давление прямо пропорционально температуре в абсолютной шкале. Этот закон формулируется следующим образом: давление газа при неизменном объеме (в пределах указанного диапазона) пропорционально его абсолютной температуре. Другими словами, если температура газа увеличивается, то и давление газа также увеличивается, а если температура уменьшается, давление газа снижается. Этот закон получил свое название в честь французских ученых Жозефа Гей-Люссака и Гей-Люи Шарля Долона.
Идеальный газ и его характеристики

Характеристики идеального газа:
- Объем (V): идеальный газ занимает объем, который можно изменять без изменения его химических свойств.
- Давление (P): давление идеального газа пропорционально количеству молекул газа и их средней кинетической энергии.
- Температура (T): температура идеального газа связана с кинетической энергией молекул газа и их движением.
- Количество вещества (n): количество вещества газа измеряется в молях и определяет количество молекул в газовом объеме.
Идеальный газ описывается уравнением состояния, которое называется уравнением Менделеева-Клайперона:
PV = nRT,
где P – давление газа, V – объем газа, n – количество вещества в молях, R – универсальная газовая постоянная, T – абсолютная температура газа.
Идеальный газ является важным понятием в физике и химии, позволяя упростить решение многих задач и проведение расчетов в различных областях науки.
Применение законов изменения объема газа
Законы изменения объема газа играют важную роль в нашей жизни и в различных областях науки и техники. Например, закон Бойля-Мариотта применяется при расчете изменения давления и объема газа при изменении температуры. Этот закон используется в химической промышленности, в процессах газообразования и в других сферах техники.
Закон Шарля или закон Клапейрона-Менделеева применяется для рассчета изменения объема газа при изменении температуры, при постоянном давлении. Этот закон разработан на базе наблюдений за поведением газовых смесей и используется в химической технологии и в процессах газодобычи.
Знание и умение применять законы изменения объема газа позволяют специалистам в различных областях науки и техники эффективно проводить расчеты и прогнозировать поведение газов в различных условиях.
Вопрос-ответ

Почему объем газа уменьшается при охлаждении?
Объем газа уменьшается при охлаждении из-за уменьшения средней кинетической энергии молекул газа. При понижении температуры молекулы газа начинают двигаться медленнее, что приводит к уменьшению среднего расстояния между ними и, соответственно, к уменьшению объема газа.
Какой закон описывает изменение объема газа при охлаждении?
Изменение объема газа при охлаждении описывается законом Шарля, согласно которому при постоянном давлении объем газа пропорционален абсолютной температуре. При охлаждении газа объем уменьшается пропорционально уменьшению температуры.
Какие факторы влияют на величину изменения объема газа при охлаждении?
Величина изменения объема газа при охлаждении зависит от начального объема газа, его исходной температуры и коэффициента температурного расширения газа. Чем выше начальная температура и объем газа, тем ярче проявляется уменьшение объема при охлаждении.
Почему при охлаждении газа величина изменения объема не всегда линейна?
При охлаждении газа величина изменения объема не всегда линейна из-за учета изменения свойств газа при различных условиях. Например, при высоких давлениях или при наличии взаимодействия между молекулами газа изменение объема может быть нелинейным и зависеть от других факторов помимо температуры.