Гидролиз – важная химическая реакция, протекающая в растворе, которая проводится многими солями и кислотами. Суть гидролиза заключается в разложении электролита на ионы, которые взаимодействуют с водой, образуя кислоты или основания. Равновесие гидролиза определяется ионной активностью раствора, и температура может оказать существенное влияние на процесс.
Нагревание реакционной смеси может привести к смещению равновесия гидролиза вправо, то есть в сторону образования кислоты или основания в большем количестве. Этот эффект происходит в результате изменения энтальпии реакции и активационной энергии. Увеличение температуры способствует ускорению реакции и обратным процессам, что в итоге смещает равновесие.
В данной статье мы рассмотрим механизмы и причины смещения равновесия гидролиза вправо при нагревании, а также последствия этого процесса для химических реакций в растворе. Понимание данного явления поможет лучше управлять реакциями и повысить эффективность химических процессов.
Механизм смещения равновесия
При нагревании смещение равновесия гидролиза вправо происходит из-за изменения температуры системы. В процессе нагревания молекулы воды начинают распадаться с более высокой энергией, что способствует увеличению концентрации ионов H+ и OH- в реакционной среде.
Таким образом, повышение температуры увеличивает скорость распада молекул воды и усиливает процесс гидролиза, что приводит к смещению равновесия в сторону образования большего количества ионов водорода и гидроксида.
Термодинамический аспект процесса

При нагревании реакционной смеси система поглощает энергию, что приводит к увеличению температуры и изменению константы равновесия реакции. Согласно принципу Ле-Шателье, смещение равновесия вправо происходит в результате повышения температуры, что в итоге приводит к увеличению концентраций продуктов гидролиза. Это связано с тем, что реакция гидролиза характеризуется положительным тепловым эффектом, т.е. теплоразделением.
| Термодинамический параметр | Реакция |
|---|---|
| Изменение энтальпии | Положительное (эндотермическая реакция) |
| Изменение энтропии | Положительное |
| Изменение свободной энергии | Отрицательное при повышении температуры |
Таким образом, термодинамический аспект процесса гидролиза позволяет объяснить смещение равновесия вправо при нагревании и обеспечить понимание механизма изменения концентраций реагентов и продуктов в системе.
Влияние температуры на константу равновесия
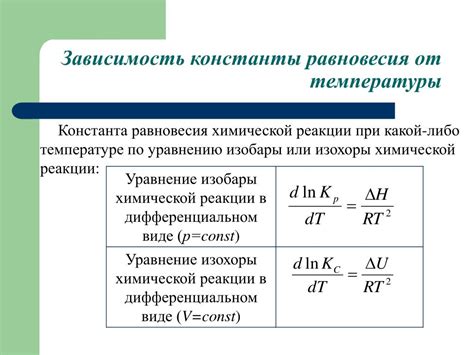
В случае гидролиза, повышение температуры приводит к увеличению константы равновесия вправо. Это объясняется тем, что при нагревании реакция, протекающая с поглощением тепла, становится более благоприятной и ее скорость увеличивается.
Таким образом, изменение температуры оказывает существенное влияние на равновесие гидролиза, обусловленное изменением энергетических условий химической реакции и направлением тепловых эффектов.
Роль энтальпии в реакции гидролиза
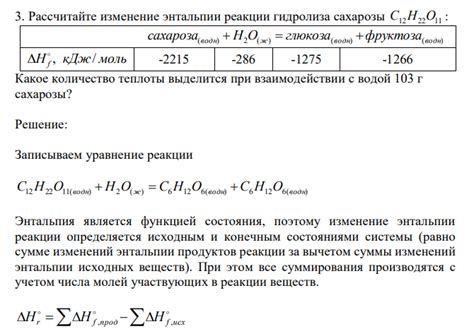
Таким образом, повышение температуры способствует повышению скорости реакции гидролиза и увеличению выхода продукта. Энтальпия играет ключевую роль в оптимизации условий реакции и обеспечивает эффективное протекание процесса гидролиза.
Энергия активации и скорость реакции

Имеется прямая зависимость между энергией активации и скоростью реакции: чем ниже энергия активации, тем быстрее проходит реакция. Поэтому смещение равновесия гидролиза вправо при нагревании обусловлено тем, что при повышении температуры частицы реагентов набирают дополнительную энергию, что способствует увеличению скорости реакции и смещению равновесия в результате образования большего количества продуктов.
Эффект концентрации реагентов
Увеличение концентрации реагентов влияет на смещение равновесия гидролиза вправо при нагревании. По закону действующих масс, при увеличении концентрации реагентов происходит увеличение скорости обратной реакции, что ведет к тому, что равновесие смещается в направлении увеличения количества продуктов гидролиза.
Эффект концентрации реагентов играет важную роль в регулировании процессов гидролиза и позволяет управлять направлением реакции при изменении условий эксперимента.
Практическое значение процесса смещения

Более того, понимание механизма и причин смещения равновесия гидролиза вправо при нагревании помогает оптимизировать условия проведения реакции, улучшить эффективность процесса и снизить затраты на производство. Это является важным фактором при разработке новых технологий и оптимизации уже существующих.
| Преимущества смещения равновесия вправо при нагревании: |
|---|
| Увеличение выхода целевого продукта |
| Повышение эффективности процесса |
| Снижение затрат на производство |
Вопрос-ответ

Почему при нагревании происходит смещение равновесия гидролиза вправо?
При нагревании реакция гидролиза обычно идет с увеличением скорости, так как температура повышает энергию молекул, стимулируя активацию химических процессов. Процесс гидролиза в отсутствие катализаторов обычно является эндотермическим, что значит, что при нагревании его равновесие будет смещаться в сторону образования более тепловой продукции, т.е. вправо, чтобы сбалансировать потребность системы в тепле.
Каким образом происходит смещение равновесия гидролиза при нагревании?
При нагревании реакция гидролиза обычно изменяет свою скорость и полноту процесса. Повышение температуры увеличивает скорость химической реакции, что может привести к смещению равновесия вправо. Это происходит из-за того, что в процессе гидролиза при повышении температуры система стремится к установлению нового равновесия с учетом изменения энтальпии.
Почему смещение равновесия гидролиза вправо при нагревании считается важным явлением в химии?
Смещение равновесия гидролиза вправо при нагревании имеет большое значение в химии, так как это явление позволяет управлять химическими реакциями и повышать выход нужной продукции. Изучение механизмов смещения равновесия при нагревании позволяет лучше понимать процессы гидролиза и оптимизировать условия проведения химических реакций для получения желаемых продуктов.