Ковалентная связь - один из фундаментальных видов соединительных химических связей, которая образуется между атомами благодаря общимиявнымэлектроным. Процесс образования ковалентной связи базируется на принципах квантовой механики, где электроны атомов разделяются, образуя общую область допустимых значений энергии.
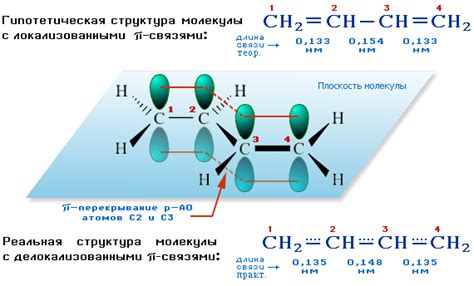
Ковалентные связи могут быть одинарными, двойными и тройными, в зависимости от числа общих пар электронов между атомами. Одинарная ковалентная связь образуется при обмене одной пары электронов, двойная - двумя парами и т.д. Ковалентные связи могут также быть полярными и неполярными в зависимости от разницы в электроотрицательности атомов в молекуле.
Принципы образования ковалентных связей
1. Способность атомов образовывать ковалентные связи зависит от количества электронов в их внешней оболочке.
2. В образовании ковалентной связи участвуют два атома, которые делят пару электронов.
3. Атомы стремятся достигнуть стабильной конфигурации внешних электронов, набирая полную октет или дуплет.
Электронный обмен в ковалентной связи
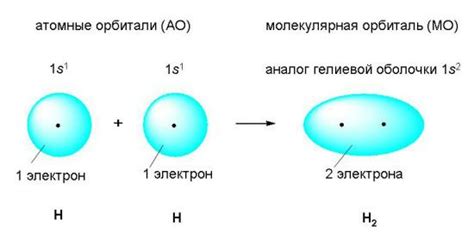
Ковалентная связь образуется между атомами за счет обмена электронами. В этом процессе каждый атом делит свои электроны с другими атомами, чтобы достигнуть наиболее стабильного электронного строения.
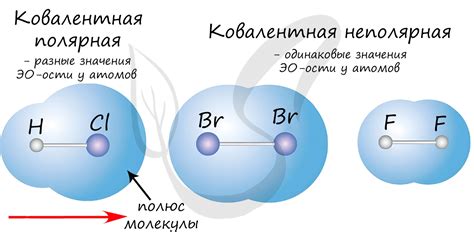
В ковалентной связи электроны могут быть равномерно распределены между атомами (нет полярности) или смещены в сторону одного из атомов (полярная связь).
Электроны в ковалентной связи делятся между двумя атомами, образуя молекулу. Каждый атом вносит свою долю электронов, образуя устойчивую систему электронов в общей оболочке.
Способы формирования ковалентной связи
Ковалентная связь может образовываться различными способами:
1. Общий электронный пар: два атома делят между собой одну пару электронов. Такая связь называется однократной ковалентной связью.
2. Структурная формула Льюиса: атомы в молекуле соединены линиями, представляющими соединительные ковалентные связи.
3. Двойная ковалентная связь: атомы делят между собой две пары электронов, образуя сильную последовательность соединений.
4. Тройная ковалентная связь: атомы делят между собой три пары электронов, обеспечивая очень сильное и стабильное соединение.
Ковалентные связи обеспечивают образование молекул и сильных химических соединений, которые являются основой для многих химических реакций и процессов в природе.
Теория молекулярных орбиталей
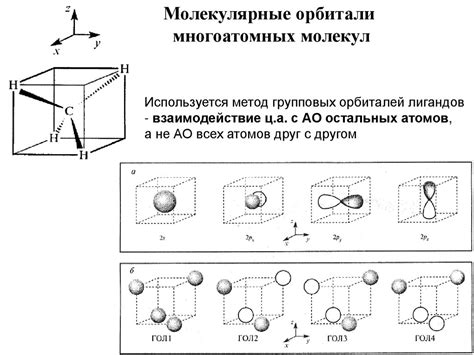
Молекулярные орбитали представлены в виде тех зон вокруг атомов, где вероятность нахождения электрона наибольшая и где могут образовываться стойкие электронные структуры молекул. Существуют два типа молекулярных орбиталей: связывающие и антиповязывающие.
Связывающие молекулярные орбитали способствуют образованию ковалентной связи, так как в них вероятность нахождения электрона между атомами высока. Наоборот, антиповязывающие молекулярные орбитали имеют узкие зоны вероятности и способствуют отражению и разрушению связи.
Теория молекулярных орбиталей позволяет с учетом структуры молекул объяснить их свойства и химическую активность, а также способствует более глубокому пониманию процессов образования и разрушения ковалентных связей.
Свойства ковалентных связей
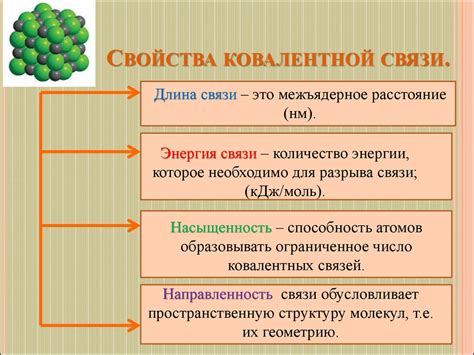
Ковалентные связи характеризуются следующими свойствами:
- Совместное использование электронной пары
- Образование молекул с определенной пространственной структурой
- Обладание направленностью
- Возможность образования одинарных, двойных или тройных связей
- Влияние сил отталкивания и притяжения между электронами
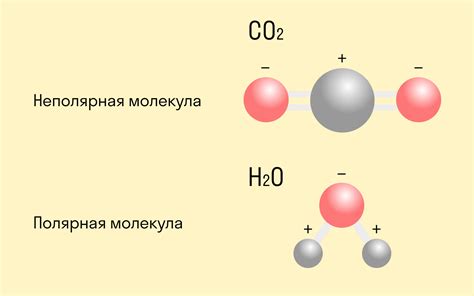
Полярные ковалентные связи
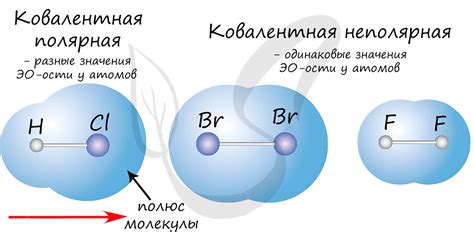
Полярные ковалентные связи возникают, когда атомы, образующие связь, имеют различную электроотрицательность. В этом случае электроны в общей внешней оболочке проводимым образом находятся ближе к более электроотрицательному атому, что приводит к разделению зарядов в молекуле. Таким образом, один атом вносит больший вклад в образование общей связи, чем другой. Полярные ковалентные связи обладают дипольным моментом, так как в молекуле возникает разделение зарядов, направление которого определяется различием в электроотрицательности атомов.
Множественные ковалентные связи
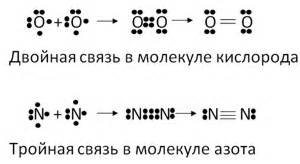
Множественные ковалентные связи могут быть двойными или тройными в зависимости от количества электронных пар, которые обменивают атомы. В случае двойной ковалентной связи два атома обменивают две пары электронов, а в случае тройной - три пары.
Множественные ковалентные связи имеют особое значение в химии органических соединений, так как они позволяют атомам удовлетворить свои потребности в электронах и образовать стабильные молекулы. Помимо того, множественные связи способствуют формированию двумерных и трехмерных структур в молекулах, что влияет на их химические и физические свойства.
Ковалентные сети и полимеры
Полимеры – это макромолекулы, состоящие из повторяющихся одинаковых молекулярных блоков, или мономеров, связанных ковалентными связями. Полимеры могут образовывать длинные цепочки или трехмерные структуры. Примерами полимеров являются полиэтилен, ПВХ, полистирол и другие пластмассы, а также белки и нуклеиновые кислоты.
Вопрос-ответ

Что такое ковалентная связь?
Ковалентная связь - это химическая связь, в которой электроны внешних оболочек атомов разделяются между ними, образуя общие электронные пары. Такие связи обычно образуются между неметаллами и являются одной из основных форм химической связи.
Какие принципы лежат в основе образования ковалентных связей?
Основой образования ковалентных связей является стремление атомов к достижению более стабильного электронного строения за счет образования общих электронных пар. При этом атомы обычно делят пары электронов таким образом, чтобы достичь заполненности электронных оболочек или полуденебных строений газообразных элементов.