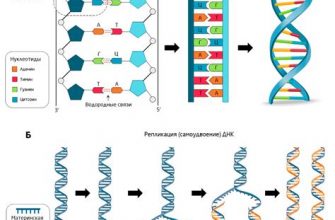
В химии степень окисления – это важное понятие, которое позволяет оценить электронное состояние атома в химическом соединении. Понимание механизмов образования степени окисления помогает определить, какие элементы участвуют в процессе окисления и восстановления в химических реакциях.
Механизм образования степени окисления связан с распределением электронов между атомами в химических соединениях. Каждый атом имеет определенную электронную конфигурацию, которая определяет его способность отдавать или принимать электроны. При образовании соединения атом может изменять свою степень окисления в зависимости от того, сколько электронов он отдал или принял.
Примеры образования степени окисления могут быть наглядно проиллюстрированы на примере ряда элементов химической таблицы. Некоторые элементы имеют постоянную степень окисления, например, натрий в соединениях всегда имеет степень окисления +1, а водород – +1 или -1 в зависимости от соединения.
Механизм образования степени окисления

Степень окисления (окислительное число) атома вещества выражается числом, которое показывает, сколько электронов должен данная атом получить или отдать, чтобы достичь стабильного состояния. Она определяется исходя из расположения атома в соединении и уровня окисления других атомов участвующих в реакции.
Механизм образования степени окисления связан с изменением числа электронов, которые атом отдает или получает при образовании соединения. При окислении атом теряет электроны, а при восстановлении – получает. Для определения степени окисления вещества необходимо учесть валентность элементов и правила расчета оксидации.
Важность электронов в процессе
Электроны играют ключевую роль в образовании степени окисления атомов. Электроны могут перемещаться между атомами и ионами, изменяя их степень окисления. При переносе электронов от одного атома к другому происходят окислительно-восстановительные реакции, которые определяют изменение степени окисления.
Электроны могут быть переданы от окисляющего агента к восстанавливающему агенту, что приводит к изменению степени окисления. Понимание роли электронов в процессе образования степени окисления помогает объяснить механизмы химических реакций и предсказать их результаты.
Ионный характер окислительно-восстановительных реакций

В химических реакциях, связанных с изменением степеней окисления элементов, важную роль играет ионный характер. Процессы окисления и восстановления часто происходят за счет обмена ионами, что позволяет передавать электроны между взаимодействующими веществами. В результате такого обмена электронами происходят изменения степеней окисления элементов в химических соединениях.
Примеры образования степени окисления
Примером образования степени окисления может служить реакция окисления железа (Fe) до ионов Fe3+. Например, при растворении железа в серной кислоте (H2SO4), железо переходит в ионы Fe2+, а затем окисляется до Fe3+:
2Fe + 3H2SO4 → 2FeSO4 + SO2 + 2H2O
Еще одним примером является реакция кислорода (O2) с металлами, в результате которой металлы окисляются до соответствующих оксидов. Например, магний (Mg) взаимодействует с кислородом, образуя оксид магния (MgO):
2Mg + O2 → 2MgO
Роль степени окисления в химических реакциях

Степень окисления играет важную роль в химических реакциях, так как позволяет определить количество электронов, участвующих в химической связи. Это понятие помогает легче понять химические свойства веществ и предсказать результаты различных реакций.
Зная степень окисления элементов в реакции, можно определить, какие вещества окисляются, а какие восстанавливаются. Это помогает понять характер реакции, установить баланс между окислителями и восстановителями, а также предсказать направление реакции.
| Пример | Реакция |
|---|---|
| Окисление железа | Fe + O2 → Fe2O3 |
| Восстановление хлора | 2KClO3 + 3H2SO4 → KCl + 2KHSO4 + 3H2O + 3Cl2 |
Влияние степени окисления на свойства веществ

Степень окисления элемента вещества играет важную роль в определении его химических свойств. Чем выше степень окисления элемента, тем более электронегативным он становится, что влияет на его способность к образованию соединений и реакций с другими элементами.
Высокая степень окисления часто приводит к более сильным химическим связям и более активным химическим реакциям. Например, металлы с высокими степенями окисления обычно обладают более высокой реакционной способностью и образуют кислотные оксиды.
С другой стороны, элементы с низкими степенями окисления могут образовывать основные оксиды или проявлять свойства катализаторов. Поэтому понимание степеней окисления элементов позволяет предсказывать и объяснять их химическое поведение в различных реакциях.
Вопрос-ответ

Что такое степень окисления в химии?
Степень окисления - это формальная числовая величина, которая присваивается атому в химическом соединении для отражения степени его окисления или восстановления. Она указывает на число электронов, которые атом отдал или принял при образовании соединения. Степень окисления может быть положительной, отрицательной или равной нулю в случае нейтральных атомов.
Как определяется степень окисления атома в химическом соединении?
Степень окисления атома определяется на основе правил атомного и ионного радиуса, электроотрицательности атома, структуры ионов и молекулы, а также зарядов элементарных частиц в соединении. Для большинства элементов существуют общие правила определения степени окисления, но в некоторых случаях требуется учитывать особенности соединения.
Какие механизмы образования степени окисления существуют в химии?
В химии существует несколько механизмов образования степени окисления. Некоторые из них включают определение заряда ионов в соединении, поиск электроположительности или электроотрицательности атомов, использование правил общественной устоявшейся степени окисления для различных элементов, анализ структуры молекулы и распределения зарядов между атомами. Каждый механизм имеет свои особенности и может применяться в определенных ситуациях.