Химия заставляет нас взглянуть на мир вокруг себя с новой перспективы, позволяя понять химические реакции и взаимодействия между веществами. Одной из важных концепций в химии является коэффициент в химическом уравнении, который указывает на количество атомов или молекул вещества, участвующих в реакции.
Определить коэффициенты в химии можно с использованием концепции валентности, которая показывает сколько электронов может вступить в химическую связь атома. Методы определения коэффициентов включают в себя анализ уравнений реакций, использование таблицы валентности элементов и правила построения химических уравнений.
Определение коэффициента в химии: важность и цель

В химии коэффициенты играют ключевую роль при составлении и балансировании химических уравнений. Они указывают на количество молекул и атомов в реакции, а также позволяют соблюдать законы сохранения массы и энергии.
Важность коэффициентов: Коэффициенты помогают правильно интерпретировать химические уравнения, представляя взаимодействие между реагентами и продуктами. Они позволяют определять пропорции и соотношения компонентов реакции.
Цель определения коэффициентов: Определение коэффициентов необходимо для корректного балансирования химических уравнений, чтобы эффективно описывать реакции и обеспечивать их понимание и интерпретацию в химии.
Метод определения коэффициента в химии по валентности
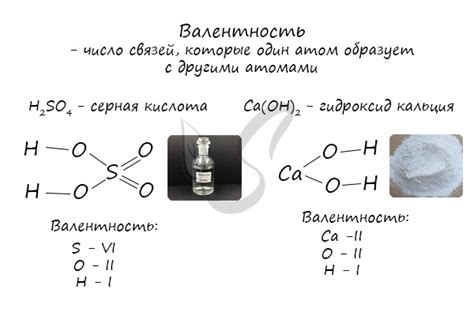
Определение коэффициента в химическом уравнении реакции возможно по валентности элементов, участвующих в реакции. Для этого необходимо:
1. Определить валентности всех элементов в реакции.
2. Составить балансированное уравнение химической реакции.
3. Найти соотношение валентностей элементов в реакции.
4. Исходя из найденных соотношений валентностей, определить коэффициент перед элементами в уравнении.
Правила определения валентности элементов
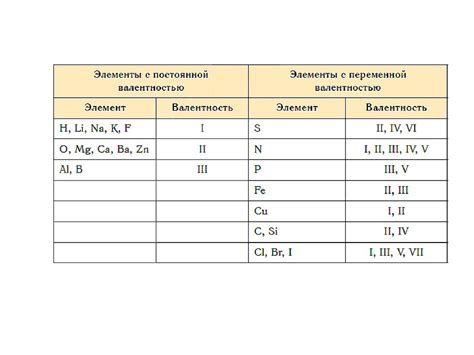
1. Валентность простых металлов: Валентность металлов в соединениях определяется как число внешних электронов в их атомной оболочке. Например, натрий (Na) имеет один внешний электрон, следовательно, его валентность равна 1.
2. Валентность неметаллов: Для неметаллов валентность равна числу электронов в их внешней оболочке, за исключением инертных газов. Например, хлор (Cl) имеет семь внешних электронов, поэтому его валентность равна 1.
3. Валентность переходных металлов: Для переходных металлов валентность может варьироваться в зависимости от окружающих элементов и условий реакции. Для определения валентности переходного металла в соединении необходимо использовать стехиометрические соотношения.
4. Ионная валентность: В случае, если элемент образует ионы, его валентность равна заряду иона. Например, ион натрия Na+ имеет валентность 1, а ион хлора Cl- имеет валентность -1.
Пример применения метода определения коэффициента

Рассмотрим задачу определения коэффициентов в химическом уравнении на примере реакции сгорания метана: CH4 + 2O2 → CO2 + 2H2O.
Используем известную валентность элементов: углерод в CH4 имеет валентность 4, кислород в O2 - 2, а также в CO2 и H2O, следовательно, коэффициенты ставим так, чтобы равнялись валентностям элементов: CH4 + 2O2 → CO2 + 2H2O.
Таким образом, наша реакция сбалансирована, и мы можем определить коэффициенты в химическом уравнении с помощью метода валентности.
Практическое применение определения валентности в химии
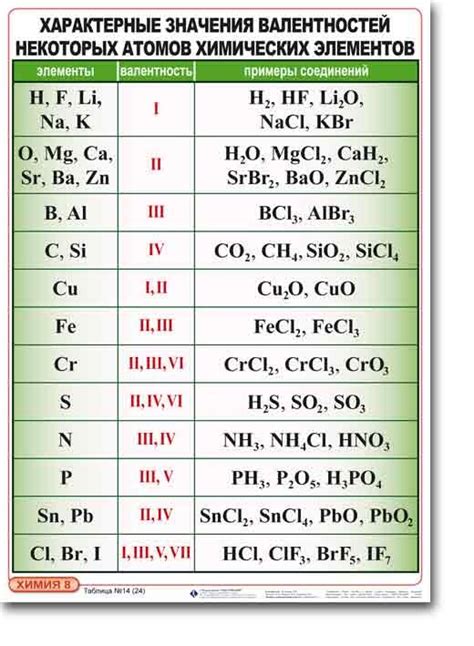
Определение валентности играет важную роль в химических реакциях и составлении химических формул. Путем определения валентности атомов элементов в соединении можно вычислить их коэффициенты и составить сбалансированные уравнения химических реакций.
Например, при рассмотрении реакции образования воды (H₂O) из водорода (H) и кислорода (O), необходимо учесть валентности атомов каждого элемента. Валентность водорода равна 1, а кислорода - 2. Следовательно, для полного соединения двух молекул водорода требуется одна молекула кислорода. Таким образом, составив уравнение реакции с учетом валентности, можно определить необходимые коэффициенты для сбалансированной реакции.
Важно помнить, что определение валентности и применение данной концепции в химии позволяет лучше понять химические процессы и облегчает работу с химическими формулами.
Шаги для точного определения коэффициента в реакции

Для определения коэффициента реакции с помощью валентностей следует выполнять следующие шаги:
- Определить валентности элементов в реакции. Это можно сделать по их позиции в периодической таблице элементов.
- Составить уравнение для взаимодействия всех элементов, учитывая их валентности.
- Выравнять количество атомов каждого элемента с обеих сторон уравнения.
- Рассмотреть коэффициент перед каждым соединением. Определить наименьший общий множитель для их коррекции.
- Проверить уравнение с учетом введенных коэффициентов. Удостовериться, что количество атомов каждого элемента сбалансировано.
После выполнения этих шагов вы сможете точно определить коэффициент в химической реакции, используя валентности элементов.
Важность правильного определения коэффициента в уравнении

В химических уравнениях коэффициенты играют ключевую роль, поскольку они позволяют соблюдать законы сохранения массы и заряда. Неправильное определение коэффициентов может привести к ошибкам в расчетах и интерпретации реакций. Например, неверно подобранный коэффициент может привести к тому, что вещества будут участвовать не в том количестве, которое должно быть согласно закону сохранения массы или заряда.
Правильное определение коэффициентов помогает точно описать химическую реакцию, учесть ее баланс и предсказать выходные данные. Поэтому важно уметь правильно определять коэффициенты и соблюдать правила и законы химии при составлении уравнений.
Как применить метод определения коэффициента в химической реакции

Для определения коэффициента в химической реакции нужно следовать нескольким шагам:
- Определить уравнение химической реакции с известными веществами и продуктами.
- Изучить валентность каждого элемента в реагентах и продуктах.
- Применить метод компенсации валентностей элементов, чтобы сбалансировать уравнение.
- Умножить все коэффициенты для достижения баланса уравнения.
Например, рассмотрим реакцию между метаном (CH4) и кислородом (O2):
CH4 + 2O2 → CO2 + 2H2O
В данном случае коэффициент перед кислородом (O2) равен 2, чтобы сбалансировать количество атомов в реагентах и продуктах.
Решение примеров по определению коэффициентов в химии

Пример 1:
Рассмотрим реакцию: Fe + O2 -> Fe2O3
Железо Fe переходит в оксид Fe2O3, чтобы сбалансировать реакцию, определим коэффициенты перед формулами веществ.
Fe + O2 -> 2Fe2O3
В данном случае получили сбалансированное уравнение реакции.
Пример 2:
Рассмотрим реакцию: C3H8 + O2 -> CO2 + H2O
Пропан C3H8 сгорает до образования CO2 и H2O.
Сбалансируем уравнение:
C3H8 + 5O2 -> 3CO2 + 4H2O
Таким образом, коэффициенты перед формулами веществ в уравнении реакции сбалансированы.
Практическое применение знания о коэффициентах в химии

1. Расчет состава химических соединений.
Зная коэффициенты в химических уравнениях, можно определить количество вещества, необходимого для реакции. Это помогает в точном расчете состава соединений и определении количества реагентов.
2. Определение стехиометрических соотношений.
С учетом коэффициентов можно определить точное количество веществ, необходимых для проведения реакции с определенным эффектом. Это особенно важно при проведении химических синтезов и анализе реакций.
3. Оценка эффективности процессов.
Знание коэффициентов помогает оценить эффективность химических процессов и выбрать оптимальные условия для их проведения. Это позволяет сэкономить ресурсы и повысить производительность процесса.
Вопрос-ответ

Что такое коэффициент в химии?
Коэффициент в химии — это число, показывающее количество молекул или атомов вещества, участвующих в химической реакции. Коэффициенты помогают сбалансировать химическое уравнение и указывают на соотношение между реагентами и продуктами реакции.
Как определить коэффициент в химии по валентности?
Коэффициент в химии можно определить по валентности атомов элементов в молекуле. Для этого необходимо знать валентность каждого элемента и взаимоотношения между ними. Путем анализа реакции и уравнения можно определить необходимые коэффициенты для сбалансированного химического уравнения.
Какие методы можно использовать для определения коэффициентов в химии?
Для определения коэффициентов в химии можно использовать метод инспекции, метод изменения ионов и метод алгебраических уравнений. Метод инспекции заключается в анализе структуры молекулы и отношениях между элементами. Метод изменения ионов заключается в изменении коэффициентов, чтобы сбалансировать заряды ионов. Метод алгебраических уравнений — это математический подход к решению задач балансировки уравнений.
Можете привести пример определения коэффициентов в химии с использованием валентности?
Например, рассмотрим реакцию образования воды из водорода и кислорода: 2H₂ + O₂ → 2H₂O. Здесь коэффициенты 2 перед H₂ и перед H₂O были определены исходя из валентности атомов веществ. Водород имеет валентность 1, кислород — 2, и чтобы сбалансировать уравнение, необходимо умножить коэффициенты перед молекулами водорода и воды на 2.
Как важно соблюдать закон сохранения массы при определении коэффициентов в химии?
Соблюдение закона сохранения массы — это важный аспект балансировки химических уравнений. При определении коэффициентов в химии необходимо учитывать, что в молекулярных реакциях масса реагентов равна массе продуктов. Поэтому правильно сбалансированное уравнение должно учитывать сохранение массы вещества.