Осадок – одно из ключевых понятий в химии, которое играет важную роль при проведении различных химических реакций. Осадок представляет собой твердые частицы, которые образуются при смешивании реагентов и проведении химических процессов. Осадок может быть видимым глазу или микроскопическим, но всегда является результатом химической реакции между веществами. Его наличие часто является ключом к определению успешности химического эксперимента или процесса.
Распознать наличие осадка и определить его природу очень важно для химиков и исследователей. Одним из способов определения осадка является наблюдение за изменениями внешнего вида и текстуры смеси веществ во время проведения химической реакции. Осадок обычно имеет отличительные свойства от реагентов, такие как цвет, форма, плотность и т.д., что помогает идентифицировать его при наличии в реакционной смеси.
Осадок в химии: суть и происхождение
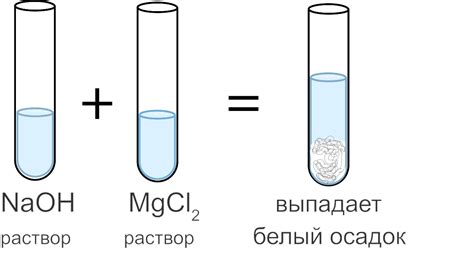
Происхождение осадка связано с образованием нерастворимых солей либо изменением условий растворения солей в растворе, что приводит к выпадению твердых частиц. Осадок может иметь различную структуру и физические свойства в зависимости от условий образования и состава исходных реагентов.
Понятие и свойства осадка
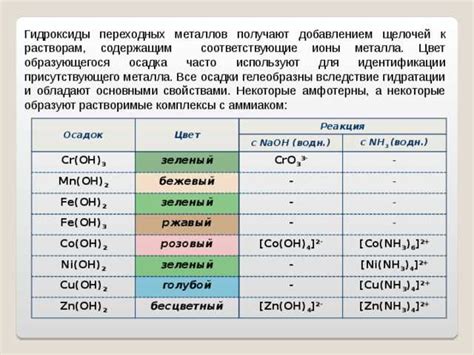
Основные свойства осадка:
- Нерастворимость: осадок обычно не растворяется в данной среде, из-за чего выпадает на дно или образует мутную суспензию.
- Цвет и текстура: осадок может иметь разнообразные цвета и структуру, что позволяет проводить его визуальное определение.
- Форма: осадок может иметь различные формы - кристаллы, частицы, пленки и т.д.
- Седиментация: осадок оседает под воздействием силы тяжести, что позволяет применять метод седиментации для его идентификации.
Механизм образования осадка
Определение осадка в химическом анализе
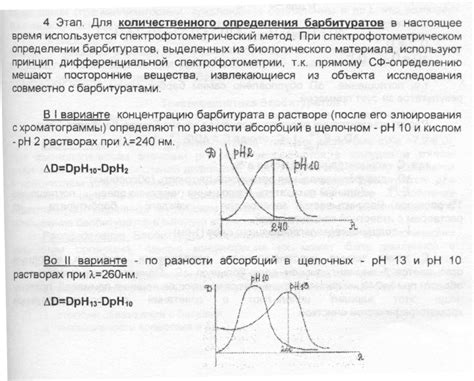
Для определения осадка часто используется метод фильтрации. После образования осадка в растворе его можно отделить от жидкой фазы, пропустив раствор через фильтрную бумагу. Твердое вещество остается на фильтре в виде осадка, который затем можно высушить и проанализировать.
Определение осадка важно для проведения химических реакций, анализа состава различных веществ и контроля качества продукции в химической промышленности и лабораториях.
Методы определения осадка

Гравиметрический метод: основанный на измерении массы осадка, образующегося после осаждения вещества. Рассчитывается исходя из массы осажденного вещества и затрат реагента.
Спектральный метод: определение осадка с использованием спектральных приборов, например, спектрофотометра. Измеряются изменения в оптических свойствах раствора после образования осадка.
Вопрос-ответ

Что такое осадок в химии?
Осадок в химии - это твердые частицы, которые образуются при взаимодействии химических веществ в реакции. Осадок может выпадать из раствора в результате изменения температуры, изменения pH, добавления определенных реагентов и прочих факторов.
Как можно определить наличие осадка в химической реакции?
Для определения наличия осадка в химической реакции можно провести оценку внешнего вида реакционной смеси - наличие твердых частиц или изменение прозрачности раствора могут свидетельствовать о выпадении осадка. Также можно использовать методы анализа осадка под микроскопом или провести химические тесты для его идентификации.
Какие факторы могут влиять на образование осадка в химической реакции?
Образование осадка в химической реакции может зависеть от различных факторов, таких как растворимость веществ, pH среды, температура, присутствие координационных соединений, наличие катализаторов и т.д. Эти факторы могут способствовать или затруднять выпадение осадка.
Какая роль осадка может играть в промышленных процессах?
В промышленных процессах осадок иногда является нежелательным явлением, так как он может вызывать забивание трубопроводов, оборудования или снижать эффективность процессов. Однако в некоторых случаях осадок может использоваться в качестве ценного продукта, например, при обогащении руд или очистке сточных вод.
Как можно предотвратить образование осадка в химических реакциях?
Для предотвращения образования осадка в химических реакциях можно контролировать условия реакции, поддерживать оптимальные pH и температуру, использовать ингибиторы осаждения, выбирать реагенты с оптимальной растворимостью и проводить реакции в специальных условиях, например, под высоким давлением.