Оксиды – это особый класс химических соединений, играющих значительную роль в нашей жизни. Они являются результатом реакции металлов или неметаллов с кислородом. Такие реакции могут привести к образованию оксидов, которые имеют различные свойства и активно участвуют в химических процессах.
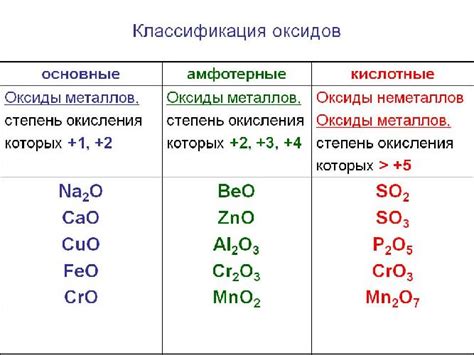
Одним из ключевых вопросов, который часто возникает в химии, является классификация оксидов: кислотные или основные? Ответ на это вопрос не так прост, как может показаться. Все дело в том, что свойства оксидов могут быть различными и зависят от их химического состава и структуры.
Кислотные оксиды, как правило, обладают кислыми свойствами и активно реагируют с водой, образуя кислоты. Такие оксиды содержат в своей структуре кислород, который может легко отдавать протоны. Примером кислотного оксида является углекислый газ (СО2), который растворяется в воде и образует угольную кислоту (Н2СО3). Кислотные оксиды также могут реагировать с основаниями, образуя соль и воду.
С другой стороны, основные оксиды характеризуются алкалической природой. Они могут реагировать с водой, образуя основания. Основные оксиды содержат в своей структуре металлы и обычно образуют гидроксиды при реакции с водой. Хорошим примером основного оксида является оксид натрия (Na2O), который при контакте с водой образует гидроксид натрия (NaOH). Такие оксиды также могут реагировать с кислотами, образуя соль и воду.
Оксиды: основники или кислотники?

Оксиды представляют собой соединения, которые образуются при взаимодействии металлов с кислородом. В зависимости от свойств оксидов, их можно классифицировать как основные или кислотные.
Основными оксидами называются соединения, которые обладают щелочными свойствами. Они образуют гидроксиды при реакции с водой и реагируют с кислотами, образуя соли. Примерами основных оксидов являются оксид натрия (Na2O) и оксид кальция (CaO).
Кислотными оксидами называются соединения, которые обладают кислыми свойствами. Они образуют соединения с основаниями при взаимодействии с водой и могут реагировать с основаниями, образуя соли. Примерами кислотных оксидов являются двуокись углерода (CO2) и оксид серы (SO2).
Однако, следует отметить, что не все оксиды однозначно можно отнести к кислотным или основным. Некоторые оксиды могут обладать как кислотными, так и основными свойствами, в зависимости от условий взаимодействия.
Таким образом, оксиды могут быть как основными, так и кислотными, что зависит от их химических свойств и условий реакции.
Оксиды и их роль в химии
Одним из основных свойств оксидов является их способность образовывать кислотные или основные растворы. Это связано с тем, что вещества, содержащие оксиды, могут реагировать с водой и образовывать кислоты или основания. Какой оксид будет кислотным или основным зависит от активности элемента и его способности отдавать или принимать протоны.
Большинство металлических оксидов обладают щелочными свойствами и их растворы имеют щелочную реакцию. Например, оксид натрия (Na2O) реагирует с водой, образуя щелочную соль – гидроксид натрия:
Na2O + H2O → 2NaOH
С другой стороны, неметаллические оксиды, такие как оксид серы (SO2) или оксид углерода (CO2), образуют кислотные растворы при реакции с водой. Например, оксид углерода реагирует с водой, образуя угольную кислоту:
CO2 + H2O → H2CO3
Оксиды также применяются в промышленности в качестве катализаторов, окислителей и реагентов. Например, оксид меди (CuO) - используется в качестве катализатора при окислительной реакции, оксид железа (Fe2O3) - является основным компонентом красок и пигментов.
Таким образом, оксиды являются важными соединениями в химии, играющими ключевую роль в различных реакциях и применяющимися в различных областях науки и промышленности.
Свойства кислотных оксидов

Кислотные оксиды оказывают ряд характерных свойств, которые делают их важными соединениями в химии. Вот некоторые из свойств кислотных оксидов:
- Кислотные оксиды обладают кислотными свойствами и образуют кислоты при взаимодействии с водой. При этом происходит реакция гидратации, в результате которой выделяется большое количество тепла.
- Кислотные оксиды растворяются в воде, образуя кислотные растворы. Эти растворы обладают кислотными свойствами и изменяют цвет индикаторов.
- Кислотные оксиды могут образовывать соли при взаимодействии с основаниями. В результате образуется ионная решетка соли, в которой положительно заряженные ионы металла связаны с отрицательно заряженными ионами кислотного остатка.
- Кислотные оксиды могут реагировать с основаниями, образуя растворимые соли и воду. Эта реакция называется нейтрализацией и является основой для производства различных продуктов, таких как удобрения или моющие средства.
- Кислотные оксиды могут образовывать кальцинаты, которые служат индикатором для определения наличия или отсутствия кислотных оксидов в образцах.
Эти свойства кислотных оксидов являются основными и определяют их химическое поведение и использование в различных отраслях науки и промышленности.
Свойства основных оксидов

1. Основные оксиды обладают высокой основностью. При контакте с водой они реагируют и образуют щелочные растворы. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH).
2. Основные оксиды обычно обладают щелочной реакцией. Они способны нейтрализовать кислоты и образовывать соли. Например, оксид кальция (CaO) реагирует с кислотой, образуя соль и воду.
3. Основные оксиды обычно являются твердыми веществами. Они имеют высокую температуру плавления и кипения, а также часто образуют кристаллическую структуру.
4. Основные оксиды образуют основные оксиды, которые обладают щелочными свойствами. Это индикатор, что оксид является основным. Основные оксиды обычно растворяются в воде, образуя щелочные растворы.
5. Основные оксиды реагируют с кислородом. Эта реакция приводит к образованию основных пероксидов или супероксидов, которые также обладают щелочными свойствами.
Важно отметить, что некоторые металлы могут образовывать не только основные оксиды, но и кислотные или амфотерные соли. Также стоит помнить, что химические свойства основных оксидов могут варьироваться в зависимости от конкретного элемента и его окисления.
Взаимодействие оксидов с водой
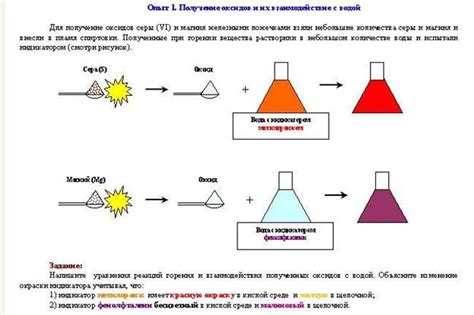
Взаимодействие оксидов с водой зависит от их химической природы и связано с образованием кислот или оснований. Соединения, в которых кислород имеет отрицательную степень окисления, называются кислотными оксидами. Как правило, кислотные оксиды реагируют с водой, образуя кислоты.
В результате взаимодействия кислотных оксидов с водой образуется сильный электролит – водный раствор кислоты. Например, оксид серы (IV) реагирует с водой, образуя серную кислоту:
SO2 + H2O → H2SO3
Основные оксиды, в свою очередь, дают основания посредством реакции с водой. Они обладают положительной степенью окисления кислорода и обычно образуют гидроксиды.
Например, оксид калия взаимодействует с водой, образуя гидроксид калия:
K2O + H2O → 2 KOH
В обоих случаях, когда оксид взаимодействует с водой, происходит высвобождение большого количества тепла, что может привести к повышению температуры реакционной среды.
Понимание взаимодействия оксидов с водой имеет большое значение в различных областях химии, включая аналитическую, неорганическую и органическую химию. Это является основой для понимания реакций оксидов в организмах живых организмов, а также для использования оксидов в промышленных производствах и технологиях.
Применение оксидов в промышленности

Одним из самых распространенных применений оксидов является их использование в качестве катализаторов при процессах органического синтеза. Оксиды металлов, такие как оксид цинка или оксид железа, обладают высокой активностью и способностью ускорять химические реакции.
Оксиды также используются как составные части керамических материалов, таких как стекло и керамические плитки. Оксиды, такие как оксид кремния или оксид алюминия, придают керамике необходимую прочность и устойчивость к температурным воздействиям.
Еще одним важным применением оксидов является их использование в производстве электронных компонентов. Некоторые оксиды, например оксид цинка, обладают полупроводниковыми свойствами, что позволяет использовать их в изготовлении датчиков и транзисторов.
Оксиды используются и в производстве красок и пигментов. Некоторые оксиды, такие как оксид железа, обладают яркими цветами, что делает их полезными в производстве красок для различных применений.
Также оксиды широко применяются в области катализа при очистке отходов в промышленности. Оксиды, такие как оксид алюминия или оксид циркония, используются в процессах, направленных на снижение выбросов вредных веществ в атмосферу.
| Название оксида | Применение |
|---|---|
| Оксид железа (III) | Используется в производстве красок и пигментов |
| Оксид цинка | Применяется в производстве электронных компонентов |
| Оксид силвернитриль | Используется в качестве катализатора в процессах органического синтеза |
| Оксид алюминия | Применяется в производстве керамических материалов |
| Оксид циркония | Используется в процессах очистки отходов в промышленности |
Благодаря своим разносторонним свойствам и широкому спектру применения, оксиды играют важную роль в различных отраслях промышленности.