Сернистый газ – это вещество, вызывающее множество противоречивых мнений среди ученых. Он состоит из серы и кислорода, и поэтому может быть классифицирован как оксид. Однако, вопрос о том, является ли сернистый газ оксидом кислотным или основным, остаетсю открытым до сих пор.
Оксиды кислотные – это соединения, которые образуются в результате соединения вещества с кислородом. Они обычно обладают кислыми свойствами и могут реагировать с основаниями. Тем не менее, сернистый газ обладает некоторыми особенными свойствами, которые отличают его от других оксидов кислотных.
Сернистый газ, иначе известный как диоксид серы, характеризуется резким запахом и является очень токсичным веществом. Он образуется при сгорании серосодержащих материалов, таких как уголь, нефть или природный газ. Если его вдыхать в большом количестве, сернистый газ может вызывать раздражение дыхательных путей и даже серьезные проблемы с здоровьем.
Роль сернистого газа в химических реакциях

Сернистый газ может действовать как оксид кислотный или основной в зависимости от условий реакции. В кислотной среде сернистый газ реагирует с водой, образуя сульфиты и сульфаты. Например, реакция SO2 + H2O → H2SO3 – образование серной кислоты, которая широко используется в различных отраслях промышленности.
Также сернистый газ может проявлять основные свойства в реакциях с кислотами. Например, реакция SO2 + 2HCl → H2S + Cl2 – образование сероводорода и хлора, что является важным промежуточным этапом в производстве хлора и серной кислоты.
Сернистый газ также широко применяется в производстве сульфитной бумаги, используемой для производства картона, бумаги и других продуктов. Кроме того, сернистый газ может быть использован в качестве консерванта в пищевой промышленности, где он предотвращает окисление и сохраняет свежесть пищевых продуктов.
Таким образом, сернистый газ играет важную роль в множестве химических реакций, выполняя функцию оксида кислотного или основного. Его свойства и возможности использования делают его ценным компонентом в различных отраслях промышленности.
Химические свойства сернистого газа

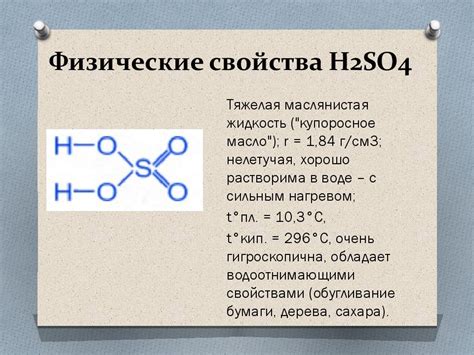
1. Кислотные свойства: Сернистый газ является оксидом серы и поэтому обладает кислотными свойствами. Он может реагировать с водой, образуя серную кислоту (H2SO3), что приводит к снижению pH. Таким образом, сернистый газ способен вызывать кислотные дожди и влиять на качество почвы и водоемов.
2. Реакция с основаниями: Сернистый газ может также реагировать с основаниями, образуя соли – сульфиты. Например, реакция сернистого газа с гидроксидом натрия приводит к образованию натриевого сульфита (Na2SO3). Эта реакция широко используется в промышленности для получения сульфитной целлюлозы и других сульфитных продуктов.
3. Окислительные свойства: Несмотря на свою кислотность, сернистый газ также обладает окислительными свойствами. Он может вступать в реакцию с некоторыми веществами, окисляя их. Например, сернистый газ может окислить некоторые соединения металлов, образуя сульфаты или сульфиты.
4. Образование аэрозолей: При взаимодействии с водной паром и другими веществами в атмосфере, сернистый газ может образовывать аэрозоли – мелкие частицы, что имеет значительное воздействие на климат и формирование облаков.
5. Реакция с органическими веществами: Сернистый газ может также реагировать с органическими веществами и образовывать соединения, такие как сульфоксиды и сульфоны. Эти соединения могут быть вредными для живых организмов и могут вызывать различные заболевания.
Реакция сернистого газа с кислотами

В действительности, реакция сернистого газа с кислотами происходит по стандартному сценарию реакции с кислотой. При контакте сернистого газа с кислотой образуется соль и вода. Реакция протекает с образованием характеристического сульфитного иона.
Пример единственной из возможных реакций сернистого газа с кислотой:
- SО2 + 2HCl → H2SO3 + Cl2
В данной реакции сернистый газ реагирует с хлороводородной кислотой, образуя сульфатную кислоту и хлор.
Сернистый газ как оксид кислотный

Как оксид кислотный, сернистый газ реагирует с водой, образуя серную кислоту (H2SO4). Это происходит в атмосфере, когда сернистый газ вступает в контакт с водяными каплями, образующимися в результате конденсации. Образование серной кислоты вызывает кислотные дожди, которые могут иметь разрушительный эффект на окружающую среду, включая леса, водные системы и здания.
Сернистый газ также проявляет кислотные свойства при взаимодействии с основаниями, образуя соли сернистой кислоты. Эти соли известны как сульфиты и широко используются в пищевой, фармацевтической и других отраслях промышленности.
Сернистый газ, как оксид кислотный, обладает раздражающими свойствами и может вызывать проблемы со здоровьем у людей и животных при высоких концентрациях. Поэтому контроль выбросов сернистого газа имеет большое значение для обеспечения чистого окружающего воздуха и предотвращения негативных последствий для здоровья.
Характеристики окислительности сернистого газа
Сернистый газ реагирует с многими веществами, образуя различные продукты окисления. Например, он окисляет металлы, образуя сульфаты. К примеру, реакция между сернистым газом и железом приводит к образованию сульфата железа:
- SO2 + Fe → FeSO3
Также сернистый газ может окислять органические соединения, образуя сульфокислоты. Например, при контакте с этиленом образуется этиленсульфокислота:
- SO2 + C2H4 → HO3SCH2CH2SO3H
Окислительные свойства сернистого газа позволяют ему использоваться в различных производственных процессах. Он применяется в производстве сульфитной целлюлозы, при дезинфекции питьевой воды, в химической промышленности.
Необходимо учитывать, что сернистый газ также обладает выраженной ядовитостью, поэтому его использование требует соблюдения соответствующих мер безопасности.
Взаимодействие сернистого газа с щелочами
Сернистый газ реагирует с щелочами, такими как гидроксиды металлов, гидроксид натрия или гидроксид калия, образуя сульфиты и сульфаты металлов. Например, реакция между сернистым газом и гидроксидом натрия выглядит следующим образом:
- SO2 + 2NaOH → Na2SO3 + H2O
При этой реакции образуется сульфит натрия и вода. Сернеобразующие реакции с щелочными растворами являются экзотермическими и сопровождаются выделением тепла.
Физико-химические свойства сульфитов и сульфатов металлов различаются и зависят от использованной щелочи. Сульфиты обладают более высокой растворимостью в воде и могут использоваться в производстве пищевых добавок и в качестве отбеливателей. Сульфаты, напротив, менее растворимы и находят свое применение в строительстве, агрохимии и других отраслях.
Взаимодействие сернистого газа с щелочами может быть регулировано различными факторами, такими как температура, давление и концентрация реагентов. В зависимости от условий, реакция может протекать медленно или быстро, с выделением или без выделения побочных продуктов.
Таким образом, сернистый газ проявляет кислотные свойства при взаимодействии с щелочами, образуя соли серных кислот. Это важно учитывать при промышленном использовании сернистого газа и контроле его выбросов, чтобы минимизировать воздействие на окружающую среду.
Сернистый газ как основание в некоторых реакциях
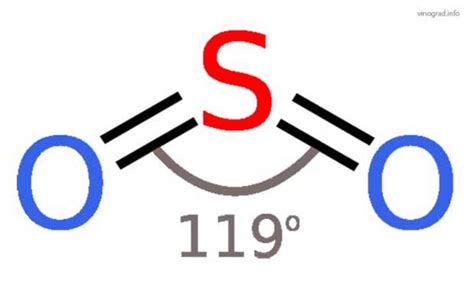
Сернистый газ (сернистый ангидрид) SO2 обладает основными свойствами и может выступать в качестве основания в некоторых химических реакциях. Он способен принять протон (H+) от воды или других кислотных соединений, образуя соответствующие соли.
Примером реакции с участием сернистого газа в роли основания является взаимодействие соляной кислоты (HCl) с сернистым газом:
SO2 + 2HCl → H2SO4 + 2Cl2
В данной реакции молекула сернистого газа SO2 отдает два протона (H+) молекулам HCl, образуя серную кислоту H2SO4 и хлориды Cl2.
Также сернистый газ может реагировать с основами, например, с гидроксидами щелочных металлов:
SO2 + 2NaOH → Na2SO3 + H2O
В результате этой реакции образуется сульфит натрия Na2SO3 и молекула воды H2O. В данном случае сернистый газ действует как основание, принимая протон от гидроксид-иона OH- и образуя соответствующую соль сульфит натрия.
Таким образом, в некоторых реакциях сернистый газ может проявлять не только кислотные, но и основные свойства, что позволяет использовать его в различных процессах и технологиях.
Кислотные и основные свойства сернистого газа

Сернистый газ (SO2) обладает как кислотными, так и основными свойствами в зависимости от условий реакции. Это делает его амфотерным веществом, способным проявлять различные химические взаимодействия в зависимости от среды.
В кислотных реакциях сернистый газ выступает в качестве оксид кислорода, образуя с водой сульфиты, а иногда и сульфаты. Соответствующие реакции протекают с образованием кислотных ионов и изменением окислительного состояния серы.
Однако в основных реакциях сернистый газ может действовать как основание, принимая протоны и образуя соответствующие соли. Такие реакции основания нередко наблюдаются в водных растворах в присутствии кислорода и катализаторов.
Кроме того, сернистый газ может участвовать в реакциях с другими веществами, проявляя как кислотные, так и основные свойства. Например, он может образовывать сложные соединения с металлами, обладающими как кислотными, так и основными свойствами.
Таким образом, сернистый газ представляет собой важное химическое соединение, которое проявляет амфотерные свойства и способно взаимодействовать как с кислотами, так и с основаниями. Это делает его значимым компонентом в различных процессах, таких как производство удобрений, а также в окружающей среде, где его выпуск часто является результатом промышленной деятельности.