Оксид железа 3 - одно из наиболее распространенных железосодержащих соединений в природе, которое имеет множество применений в промышленности, медицине и других областях. Это соединение обладает характерным красным цветом, который делает его легко узнаваемым. Но как именно можно получить этот важный продукт?
В данной статье мы рассмотрим различные способы получения оксида железа 3, как с помощью химических реакций, так и из природных источников. Узнаем, какие вещества необходимы и какие условия требуются для успешного синтеза этого соединения.
Оксид железа 3: что это
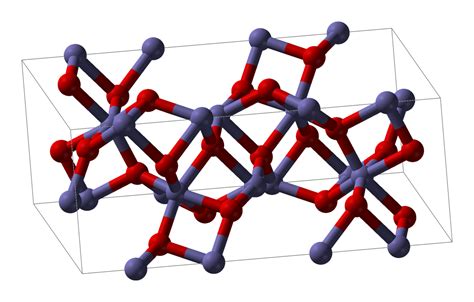
Химический состав и свойства
- Оксид железа 3 обладает высокой термической стабильностью и устойчив к окислению.
- Этот вид оксида широко используется в промышленности, в том числе в производстве красок, керамики, стекла и металлургии.
- В природе оксид железа 3 встречается в виде минерала гематита и красной глины. Он также может образовываться в результате окисления других соединений железа в атмосфере.
Производство оксида железа 3

Другим способом производства Fe2O3 является окисление железа влажным воздухом при повышенной температуре. Этот метод также требует тщательного контроля параметров процесса для получения высококачественного продукта.
Производство оксида железа 3 имеет большое промышленное значение, поскольку этот продукт широко используется в производстве красок, керамики, катализаторов и других продуктов.
Химические реакции с участием оксида железа 3

- Реакция с кислородом: Fe2O3 + 3O2 → 2Fe2O3.
- Реакция с водой: Fe2O3 + 3H2O → 2Fe(OH)3.
- Реакция с кислотами: 2Fe2O3 + 6HCl → 4FeCl3 + 3H2O.
Природные источники оксида железа 3

Оксид железа 3 можно найти в различных природных источниках, включая:
| 1. | Гематит (Fe2O3) |
| 2. | Церуссит (PbFe3(CO3)3(OH)2) |
| 3. | Лимонит (FeO(OH)·nH2O) |
Эти природные источники оксида железа 3 могут быть использованы для получения соединений железа на промышленном и научном уровне.
Вопрос-ответ

Чем полезен оксид железа 3?
Оксид железа 3 (Fe2O3) имеет широкое применение в промышленности, в частности, в производстве стали, производстве красок и пигментов, изготовлении магнитов и керамики. Он также используется в медицине и косметике.
Каким образом можно получить оксид железа 3?
Оксид железа 3 можно получить путем нагревания гидроксида железа или окисления металлического железа при воздействии кислорода. Также его можно получить путем добавления щелочи или кислоты к соли железа 2-й степени.
Где можно найти природные источники оксида железа 3?
Оксид железа 3 встречается в природе в виде минерала гематита. Его можно найти в железных рудах, особенно вместе с магнетитом. Также оксид железа 3 содержится в красной глине и почве.
Какие химические реакции протекают при получении оксида железа 3?
При получении оксида железа 3 происходят различные химические реакции. Например, при нагревании гидроксида железа Fe(OH)3 образуется Fe2O3. Также при окислении железа Fe кислородом образуется Fe2O3.
Каковы основные свойства оксида железа 3?
Оксид железа 3 обладает красновато-коричневым цветом, он нерастворим в воде, но может растворяться в кислотах. Этот оксид применяется как краситель, а также обладает магнитными свойствами.