Алканы - это насыщенные углеводороды, содержащие только одиночные связи между углеродными атомами. Они являются самыми простыми углеводородами и имеют общую формулу CnH2n+2. Алканы обладают низкой реакционной способностью, так как их химическая активность ограничена только сжиганием в присутствии кислорода.
Алкены, в отличие от алканов, содержат одну или несколько двойных связей между углеродными атомами. Их общая формула CnH2n позволяет им проявлять большую химическую активность по сравнению с алканами. Алкены широко используются в органическом синтезе для получения различных продуктов синтеза.
Алкины - это углеводороды с одной или несколькими тройными связями между углеродными атомами. Их общая формула CnH2n-2. Алкины обладают химической активностью, промежуточной между алканами и алкенами. Они также находят применение в органическом синтезе, например, в производстве пластиков и резин.
Основные характеристики алканов

2. Физические свойства: Алканы обычно представляют собой газы или жидкости при комнатной температуре и давлении, за исключением более крупных молекул, которые могут быть твердыми.
3. Химическая реактивность: Алканы являются наиболее устойчивыми углеводородами и в целом малоактивными. Они не образуют двойных или тройных связей и чаще всего участвуют в горениях и замедленных окислительных реакциях.
Молекулярное строение алканов и их свойства
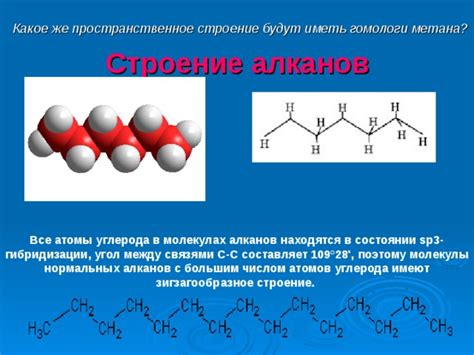
Основные свойства алканов:
1. Алканы являются низкоплотными безцветными газами, жидкостями или твердыми веществами;
2. Алканы хорошо смешиваются с неполярными растворителями, но практически не смешиваются с водой;
3. Алканы легко горят в воздухе, образуя углекислый газ и воду;
4. Алканы являются низкотоксичными и не реагируют с кислотами или щелочами при обычных условиях.
Виды взаимодействий алканов с другими соединениями
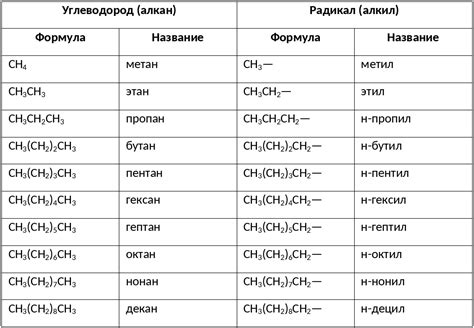
Окисление алканов: Алканы способны подвергаться окислению в присутствии кислорода или других окислителей. В результате окисления образуются соответствующие алканолы, альдегиды или карбоновые кислоты.
Гидрохлорирование алканов: Алканы могут реагировать с хлором в присутствии уф-излучения или при высокой температуре, образуя галогеналканы.
Дегидрирование алканов: При нагревании алканов высоких углеродных чисел можно получить алкены и алкины в результате удаления молекулы воды.
Каталитическое крекинг: Алканы могут подвергаться крекингу в присутствии катализатора, что приводит к разрыву углеродной цепи и образованию более легких алканов и алкенов.
Отличия в строении алкенов

Строение алкенов можно обозначить общей формулой CnH2n, где n - число углеродов в молекуле. За счет этой формулы можно легко определить количество водородов в молекуле алкена.
Двойная связь и его влияние на свойства алкенов

Анализ реакционной способности алкенов
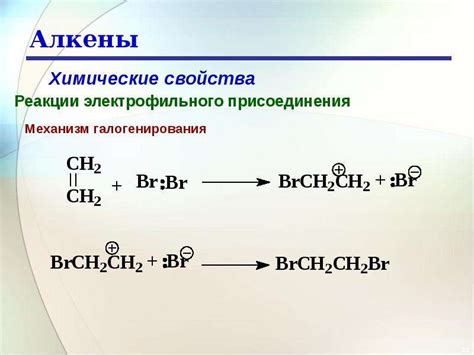
Одна из характерных реакций для алкенов - это аддиция, когда к двойной связи прилипает химический элемент или группа элементов. Примерами аддиции являются гидрирование (добавление водорода) и гидроборирование (добавление бора и водорода).
- Гидрирование: C=C + H2 → C-C
- Гидроборирование: C=C + BH3 → C-BH2
Другим важным типом реакций для алкенов является полимеризация, когда из мономеров - молекул с двойными связями - образуются длинные полимерные цепи. Примерами полимеризации являются полиэтилен и полистирол.
Особенности строения и свойства алкинов
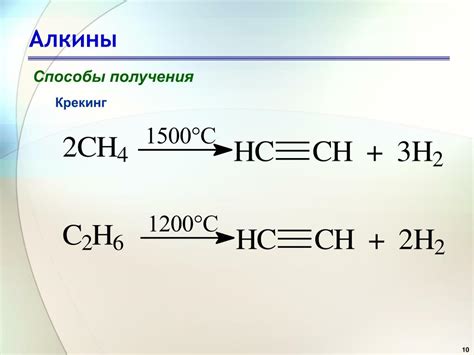
Алкины представляют собой углеводороды, содержащие тройную связь между углеродными атомами. Тройная связь делает алкины более реакционноспособными, чем алканы и алкены. Каждый углерод в алкине имеет гибридизацию sp, что позволяет иметь прямую линейную структуру.
Основные свойства алкинов:
| 1. Реакционная способность | Алкины проявляют повышенную реакционную способность благодаря наличию тройной связи, которая может быть легко разрывана в результате химических реакций. |
| 2. Кислотность | Алкины обладают высокой кислотностью из-за наличия ацетиленовой (тройной) связи. Они могут реагировать с основанием и образовывать соли. |
| 3. Полимеризация | Алкины способны участвовать в полимеризации, образуя полимеры с высокой молекулярной массой, такие как полиэтилен. |
Тройная связь в молекулах алкинов и их вещественные характеристики
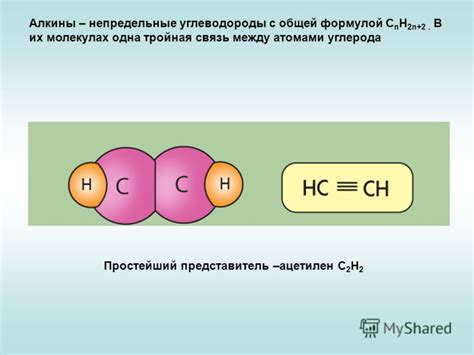
Тройная связь состоит из одной σ-связи и двух π-связей. Она обладает более высокой энергией и реакционной активностью по сравнению с двойными связями.
Из-за тройной связи в молекулах алкинов наблюдается линейность строения и плоскость молекулы, что влияет на их физические и химические свойства.
Алкины обладают более низким плавучесть и кипучесть в сравнении с алканами и алкенами из-за их более высокой молекулярной массы и сложной структуры.
Тройная связь в алкинах играет ключевую роль в различных органических реакциях, делая их важными для синтеза органических соединений.
Вопрос-ответ

Какие основные отличия между алканами, алкенами и алкинами?
Основное отличие между алканами, алкенами и алкинами заключается в наличии двойных или тройных связей между атомами углерода. Алканы содержат только одинарные связи между углеродами, алкены содержат одну двойную связь, а алкины имеют одну тройную связь. Количество связей между атомами углерода влияет на их химические свойства и реакционную способность.
В чем заключаются особенности химии алкенов по сравнению с алканами и алкинами?
Основная особенность химии алкенов заключается в наличии двойной связи между углеродами. Эта двойная связь делает алкены более реакционноспособными по сравнению с алканами, поскольку она может подвергаться различным химическим реакциям, включая полимеризацию, гидрирование, и аддиционные реакции. Кроме того, алкены часто используются в синтезе органических соединений и имеют широкое применение в промышленности.
Какие примеры могут быть даны алканов, алкенов и алкинов?
Примеры алканов включают метан, этан, пропан и бутан - углеводороды, в которых присутствуют только одинарные связи между атомами углерода. Примеры алкенов включают этилен, пропилен и бутенил - углеводороды с двойными связями между атомами углерода. Алкины могут быть представлены ацетиленом, пропином и бутиным - углеводороды, содержащие тройные связи между углеродами.