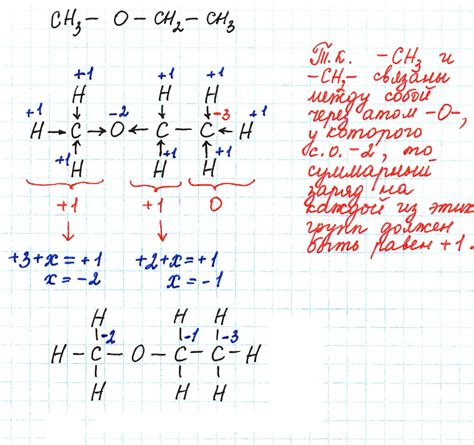
Степень окисления атома в химии определяет, насколько атом с атомным ядром с положительным зарядом или соединение с отрицательным зарядом отличается от нейтрального атома. Для расчета суммы степеней окисления каждый атом учитывается в соответствии с его уровнем окисления.
Примером может служить расчет суммы степеней окисления в молекуле H2SO4. Для серы в этом соединении степень окисления равна +6, для водорода +1, а для кислорода -2. Путем сложения степеней окисления каждого атома в молекуле мы можем рассчитать общую сумму степеней окисления и выяснить характер взаимодействия вещества.
Формула нахождения степени окисления
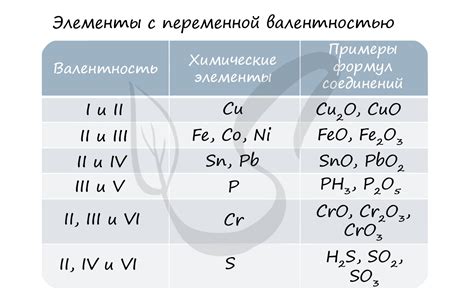
Степень окисления элемента в соединении вычисляется умножением его количества на его степень окисления и суммированием результатов для всех элементов в молекуле. Формула:
Сумма степеней окисления = (количество элемента 1)*(степень окисления элемента 1) + (количество элемента 2)*(степень окисления элемента 2) + ...
Например, для молекулы H2SO4 сумма степеней окисления будет:
(2*1) + (1*(-2)) + (4*0) = 2 - 2 + 0 = 0
Определение степени окисления

Степень окисления может быть положительной, отрицательной или нулевой, и она определяется правилами атомного веса и заряда атома. Для расчета степеней окисления используются особые правила, учитывающие электроотрицательности элементов и тип связей.
Как определить степень окисления

Степень окисления атома в молекуле определяется исходя из правил расчета и заряда атома в соединении. Для этого можно использовать следующие шаги:
| 1. | Определите химический состав молекулы, включая элементы и их количество. |
| 2. | Выразите уравнение реакции вида А + В → С + D, где A, B, C, D - элементы веществ. |
| 3. | Исследуйте структуру молекулы и найдите атом, степень окисления которого нужно определить. |
| 4. | Присвойте каждому атому его электроотрицательность и определите его формулу соединения. |
| 5. | Используйте известные правила определения степени окисления для расчета заряда атома в соединении. |
Примеры расчета суммы степеней окисления

Рассмотрим пример расчета суммы степеней окисления молекулы H2SO4.
| Элемент | Степень окисления |
| H | +1 |
| S | +6 |
| O | -2 |
Сумма степеней окисления: 2(+1) + 6 + 4(-2) = 2 + 6 - 8 = 0. Значит, сумма степеней окисления в молекуле H2SO4 равна 0.
Другой пример - молекула KMnO4:
| Элемент | Степень окисления |
| K | +1 |
| Mn | +7 |
| O | -2 |
Сумма степеней окисления: +1 + 4(+7) + 4(-2) = 1 + 28 - 8 = 21. Сумма степеней окисления в молекуле KMnO4 равна 21.
Пример расчета степени окисления элемента

Для того чтобы рассчитать степень окисления элемента в молекуле, необходимо следовать определенным шагам. Рассмотрим пример на простом соединении:
- Рассмотрим молекулу воды H2O. В этой молекуле известно, что кислород имеет степень окисления -2 (согласно правилам расчета степеней окисления).
- Водород в молекуле воды обычно имеет степень окисления +1.
- Примем, что один атом водорода имеет степень окисления +1 (так как в молекуле два атома водорода, общая степень окисления водорода будет +2).
Итак, сумма степеней окисления всех элементов в молекуле H2O равна: (-2) + (+2) = 0. Сумма равна нулю, что соответствует заряду нейтральной молекулы воды.
Определение степени окисления в химическом соединении
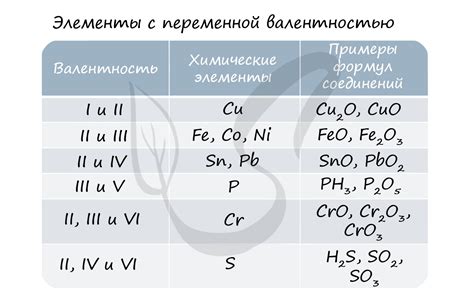
Для определения степени окисления элемента в молекуле нужно учитывать следующие правила:
- Степень окисления элемента в элементарном состоянии равна нулю.
- Для ионов степень окисления равна заряду иона.
- В соединениях кислорода степень окисления
Значение суммарной степени окисления в молекуле
Суммарная степень окисления в молекуле помогает определить общий электронный баланс атомов в соединении. Это показатель, который выражает степень окисления каждого атома в молекуле относительно своего нулевого состояния.
Как правило, сумма степеней окисления всех атомов в молекуле равна нулю для нейтральных соединений или равна заряду молекулы для ионов. Для расчета суммарной степени окисления в молекуле применяется формула:
Суммарная степень окисления = сумма степеней окисления каждого атома в молекуле
Знание суммарной степени окисления помогает определить химические свойства вещества и его реакционную способность.
Расчет суммарной степени окисления в данной молекуле
Для определения суммарной степени окисления в молекуле необходимо учесть степени окисления каждого атома в соединении, учитывая их численное значение и знак.
Процесс расчета суммарной степени окисления включает следующие шаги:
- Определите степень окисления каждого атома, исходя из известных правил и связей в молекуле.
- Умножьте степень окисления каждого атома на количество соответствующих атомов в молекуле.
- Суммируйте полученные значения степеней окисления для всех атомов в молекуле.
Пример расчета суммарной степени окисления:
- В молекуле H2O степень окисления атома H равна +1, а атома O равна -2.
- Учитывая, что в молекуле H2O присутствует 2 атома H и 1 атом O, расчет будет выглядеть так:
- Для атомов H: 2(H) * (+1) = +2.
- Для атомов O: 1(O) * (-2) = -2.
- Суммарная степень окисления: +2 - 2 = 0.
Таким образом, суммарная степень окисления в молекуле H2O равна 0, что является характеристикой ее нейтральности.
Вопрос-ответ
Какая формула используется для расчета суммы степеней окисления в молекуле?
Сумма степеней окисления в молекуле рассчитывается по формуле: ΣSO = 0, где ΣSO - сумма степеней окисления всех элементов в молекуле.
Какие примеры можно привести для расчета суммы степеней окисления в молекуле?
Например, для молекулы H2O (воды) сумма степеней окисления будет равна 0: (+1) * 2 - 2 = 0. Для молекулы CO2 (диоксида углерода) сумма степеней окисления равна 0: (+4) + 2 * (-2) = 0.
Почему сумма степеней окисления всех элементов в молекуле должна быть равна 0?
Сумма степеней окисления элементов в молекуле должна быть равна 0, так как молекула в целом является нейтральной. Это связано с сохранением заряда в химической реакции.
Как можно использовать расчет суммы степеней окисления в химической практике?
Расчет суммы степеней окисления позволяет определить соединения элементов в молекуле и составить химические уравнения. Это помогает в понимании химических реакций, составлении балансированных уравнений и определении степеней окисления элементов.